魏祯祯,宋程威,郭丽丽,郭 琪,侯小改
(河南科技大学农学院,河南 洛阳 471023)
AP2/ERF转录因子作为乙烯信号传导的重要调节因子家族,由高度保守的AP2/ERF DNA结构域组成,其中含有60~70个氨基酸[1-2]。近年来AP2/ERF转录因子陆续在不同植物中被鉴定出来,例如拟南芥(Arabidopsisthaliana)中含有147个,其中122个基因属于ERF家族,只含有1个AP2/ERF结构域;水稻(Oryzasativasubsp.japonica)中含有139个基因[3];葡萄(Vitisvinifera)中含有149个基因,这些基因中至少含有1个AP2/ERF结构域[4];白菜(Brassicarapavar. glabra)中鉴定出291个,白菜AP2/ERF基因家族同样分为AP2、ERF、RAV和其他4个亚族[5];甜橙(Citrussinensis)中有108个基因[6]。大量研究表明,ERF亚族基因在叶衰老、阻遏铁的获取、负调节植物抗盐性等方面也发挥着重要的作用。在拟南芥中AtERF4和AtERF8可以通过靶向表硫代物蛋白/表硫代物调节衰老基因和许多与衰老相关基因的表达来加速早熟叶片的衰老[7]。在小金海棠(Malusxiaojinensis)中MxERF4与MxFIT转录因子的蛋白相互作用,MxERF4直接与其启动子结合抑制了铁转运蛋白MxIRT1的表达,利用病毒沉默抑制MxERF4基因的表达可致使MxIRT1表达量增加[8]。在苹果(Malusdomestica)中MdERF4过表达对苹果的耐盐性有负调节作用,并且能够直接抑制MdERF3的表达[9]。也有研究发现,ERF转录因子与植株衰老、花瓣脱落和花期调控密切相关[10]。研究表明,拟南芥AtERF4基因前体因mRNA的多聚腺苷酸化作用而存在于两种不同的亚型,ERF4-R含有EAR基序,起阻遏作用;而另一种形式ERF4-A缺乏这一基序,起激活作用,这两种亚型通过调控CAT3基因的表达来调控植株的衰老进程[11]。在拟南芥中,AtERF1通过直接抑制FT基因的转录来延缓开花[12]。在玫瑰(Rosahybrida)中RhERF4可以调节编码果胶代谢酶相关基因的表达,从而通过改变果胶的代谢来调节花瓣脱落。此外,RhERF4基因的表达受生长素影响,该基因表达量减少加速了花瓣的脱落,沉默RhERF4基因降低了植物离层中的果胶丰度,通过与RhBGLA1的启动子结合,降低RhBGLA1基因的表达来达到延缓花瓣脱落的目的[13]。
牡丹(Paeonia×suffruticosa)是我国传统木本名花,其栽培历史悠久,花朵色泽艳丽且典雅华贵,深受各国人民喜爱,为我国的候选国花,具有很高的观赏价值[14-15]。但由于牡丹自然花期短且集中,其早花和晚花品种相对较少,在产业化发展过程中,因无法满足人们对长观赏期的需求,严重影响牡丹的观赏产业价值并限制当地的经济发展。因此,研究其花期调控和花瓣衰老的分子生物学基础,对实现牡丹周年开花和晚花品种选育具有重要意义。
目前,前人对延长植物观赏周期的分子机制开展了一些研究,如拟南芥(Arabidopsisthaliana)PsSVP基因超表达植株与野生型植株相比,转基因植株莲座叶大而少,植株较高且延迟开花[16]。Wang等[17]研究发现PsSOC1基因在烟草中异源表达可使植株提前开花且促进植株生长,Zhang等[18]将PsSOC1基因转入拟南芥后得到同样的结论。但关于牡丹ERF转录因子家族的基因分离及花期调控相关研究还较少。本研究从牡丹品种‘凤丹’(P.ostii‘Feng Dan’)3代全长转录组数据库中,鉴定到一个与花期调控相关的AP2/ERF转录因子,命名为PoERF4,并对其进行生物信息学分析,探究PoERF4基因的时空表达模式和生长素对该基因的调控作用,以期为牡丹花瓣衰老分子机理及改良牡丹的生物性状的进一步研究提供理论基础。
1.1 试验材料
试验材料‘凤丹’属于早花牡丹品种;‘凤丹’早花突变株系是在实验过程中发现的‘凤丹’的芽变品种,该品种开花时间2020年比‘凤丹’早7 d,2021年比‘凤丹’早9 d;‘连鹤’(P.×suffruticosa‘Lianhe’)属于晚花牡丹品种,该品种开花时间2020年比‘凤丹’晚16 d,2021年比‘凤丹’晚10 d。上述3个品种均为白色系单瓣花型。
‘凤丹’取自河南科技大学试验基地,收集其露色期、初开期、半开期、盛开期、始衰期和衰败期的花瓣、叶片、茎、花萼,以及早花‘凤丹’突变株系和‘莲鹤’半开期的花瓣。当‘凤丹’达到圆桃期时,选择长势相近的植株用100 μmol/L生长素诱导处理,在处理后第1、2、4、8天分别取其花瓣,液氮速冻后,在超低温-80 ℃冰箱保存样品,用于分析生长素诱导下的基因表达模式。
1.2 总RNA提取及cDNA的合成
参照天根生化科技公司植物组织总RNA提取试剂盒说明书,提取‘凤丹’不同花期(露色期、初开期、半开期、盛开期、始衰期、衰败期)花瓣及不同组织(叶片、茎、花萼),以及‘凤丹’早花突变体和‘莲鹤’半开期的花瓣及生长素处理后的‘凤丹’花瓣的总RNA,利用1%(质量分数,下同)琼脂糖凝胶电泳检测总RNA的完整性,超微量紫外分光光度计(Nano Drop one,美国)检测总RNA的浓度。采用TaKaRa公司的反转录试剂盒(PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit)合成cDNA。
1.3 PoERF4基因的克隆
根据前期获得的‘凤丹’3代全长转录组数据库的序列,通过Primer Premier 5.0设计PoERF4基因的引物(表1),以‘凤丹’花瓣cDNA为模板,用TransStart©FastPfu Fly DNA Polymerase(全式金)进行扩增,50 μL反应体系:cDNA 2 μL,TransStart FastPfu DNA Polymerase 1 μL,5×TransStart FastPfu Buffer 10 μL,dNTP Mixture(2.5 mmol/L) 4 μL,10 μmol/L正反向引物各1~2 μL,其余加ddH2O补齐体系。扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,55~58 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸7 min。目的片段采用AxyPrep DNA凝胶回收试剂盒进行回收,回收产物与pMD18-T Vector载体连接后转入大肠杆菌DH5α感受态细胞中进行克隆,挑选阳性单克隆至生工生物工程(上海)股份有限公司测序。

表1 PoERF4基因克隆和qRT-PCR分析引物
1.4 ‘凤丹’PoERF4基因的生物信息学分析
通过Translate分析‘凤丹’PoERF4基因推导的氨基酸序列,利用ProtParam、NCBI中数据库CDD、Protscale、NetPhos和TMHHMM分别预测分析蛋白特性理化性质、保守结构域、蛋白质亲疏水性、蛋白磷酸化位点和跨膜结构。采用SPOMA和SWISS-MODEL预测蛋白质的二级和三级结构。
1.5 ‘凤丹’PoERF4基因qRT-PCR分析
根据PoERF4基因序列设计qRT-PCR特异性引物(表1),以‘凤丹’actin基因为内参基因,按照TB GreenTM Premix Ex Taq Ⅱ试剂盒的实验体系和程序按说明书进行实验,利用2-ΔΔCT法计算目的基因相对表达量[19]。采用Excel整理数据,SPSS 19.0软件处理和分析数据,Origin 8.0绘图。
2.1 ‘凤丹’PoERF4基因的克隆及推导的氨基酸序列
提取‘凤丹’花瓣总RNA,以反转录后的cDNA为模板,利用特异性引物进行RT-PCR扩增,PCR产物经1%琼脂糖凝胶电泳检测,发现在1 000 bp左右有1条清晰的特异性条带(图1),扩增到的片段长度为1 036 bp,开放阅读框(ORF)为747 bp,编码248个氨基酸,其ORF核苷酸序列与氨基酸见图2。

M.DL2000 DNA marker; 1、2. PoERF4基因amplified product of PoERF4。

图2 ‘凤丹’PoERF4基因推导的氨基酸序列Fig.2 Deduced amino acid sequences of ‘Feng Dan’ PoERF4 gene
2.2 ‘凤丹’PoERF4基因编码蛋白理化性质、保守结构域分析
PoERF4基因编码的蛋白分子式为C2 217H3 689N747O933S174,分子质量为61.315 56 kU,理论等电点(pI)为5.12,脂肪系数为23.96,不稳定系数为34.92,数值小于40,因此预测其属于稳定蛋白。运用NCBI中CDD保守结构域数据库进行保守结构域预测,结果显示,该序列存在AP2超家族结构域和特殊DNA结合位点,可推断PoERF4蛋白属于AP2家族(图3A)。

图3 PoERF4基因编码蛋白保守结构域预测,亲疏水性、跨膜结构和磷酸化位点分析Fig.3 Prediction of conserved domain, affinity and hydrophobicity, transmembrane structure and phosphorylation site analysis of PoERF4 gene coding protein
2.3 ‘凤丹’PoERF4蛋白亲疏水性、跨膜结构、磷酸化位点分析
利用Protscale在线分析工具预测PoERF4基因编码蛋白的亲疏水性预测结果显示,大多数氨基酸残基落在亲水区,预测PoERF4蛋白表现为亲水性蛋白(图3B)。‘凤丹’PoERF4编码蛋白跨膜结构在线分析显示,所有蛋白均在膜外,不存在跨膜结构(图3C)。用NetPhos软件预测分析表明,PoERF4蛋白有Ser位点可能有17个被磷酸化,Thr位点可能有8个被磷酸化,Tyr位点可能有2个被磷酸化(图3D)。
2.4 ‘凤丹’PoERF4蛋白高级结构预测分析
使用在线分析工具SOPMA对‘凤丹’PoERF4蛋白质的二级结构进行预测分析,数据表明,该蛋白序列的二级结构中α-螺旋中包含28个氨基酸,延伸链中包含48个氨基酸,β-转角中包含6个氨基酸,无规则卷曲中包含166个氨基酸,其中无规则卷曲为主要构件,且所占比例半数以上(图4)。
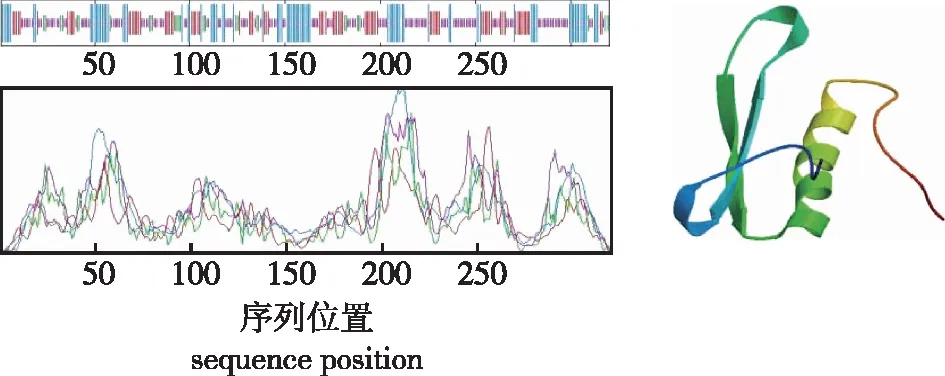
图4 PoERF4蛋白二级、三级结构预测Fig.4 PoERF4 secondary and tertiary structure prediction
2.5 ‘凤丹’PoERF4蛋白系统进化树分析
将PoERF4基因的氨基酸序列上传至NCBI在线BLAST数据库中挑选同源性较高的序列,利用MEGA软件进行系统进化树的构建和遗传距离分析,结果表明‘凤丹’PoERF4与葡萄(Vitisvinifera)、夏葡萄(Vitisasetivalis)ERF4亲缘关系较近,而与喜树(Camptothecaacuminata)、茶(Camelliasinensis)等其他植物的亲缘关系较远(图5)。

图5 ‘凤丹’PoERF4蛋白构建系统进化树分析Fig.5 The phylogenetic tree analysis of PoERF4 construction in ‘Feng Dan’
2.6 ‘凤丹’PoERF4基因的表达模式分析
以牡丹actin基因为内参基因,采用荧光定量PCR技术分析PoERF4基因在‘凤丹’牡丹花发育不同花期花瓣中的表达情况。结果显示,PoERF4基因‘凤丹’初开期和始衰期花瓣的表达量很低且无显著差异,在露色期、半开期、盛开期和衰败期花瓣的相对表达量上升,其中半开期花瓣的相对表达量最高(图6A)。

CE .露色期the color-exposure stage; IF.初开期initial flowering stage; HO.半开期half opening stage; FB.盛开期full blooming stage; ID.始衰期initial decay stage; DS.衰败期decay stage。
为研究PoERF4基因在‘凤丹’不同组织(叶片、茎、花萼和花瓣)相同发育时期的时空表达模式,本研究采用qRT-PCR技术进行了分析。结果表明,PoERF4基因在叶片、茎、花萼和花瓣中均有表达,具有组织特异性,在叶片中相对表达量最高,显著高于茎、花萼和花瓣的相对表达量(图6B)。
对于不同品种PoERF4基因在牡丹晚花品种‘莲鹤’中表达量最高,为27.63;其次是‘凤丹’中的表达量,早花‘凤丹’突变株系中表达量最低(图6C)。
为探明‘凤丹’牡丹PoERF4基因响应生长素的调控作用,收取‘凤丹’经100 μmol/L生长素处理下第1、2、4、8天的花瓣,提取所有组织RNA,进行反转录和实时荧光定量PCR分析,内参基因为actin基因。处理结果如图6D所示,生长素处理后的‘凤丹’花瓣中,PoERF4基因在‘凤丹’处理第8天时,表达丰度最高,是第1天的101倍,这表明PoERF4基因的表达受响应生长素的诱导且效果显著(图6D)。
植物叶、花、果实等器官的衰老脱落是一个高度程序化的过程,衰老相关基因和植物激素在此过程中共同调节脱落过程的进行[20]。本研究从‘凤丹’花瓣中成功分离出ERF4基因cDNA序列全长,在线预测分析表明PoERF4基因含有完整的开放阅读框,为747 bp,编码248个氨基酸。对PoERF4基因编码的蛋白分析发现,PoERF4蛋白含有AP2超家族结构域和特殊DNA结合位点,属于AP2/ERF家族,与茶(Camelliasinensis)[21]、紫花针茅(Stipapurpurea)[22]和蝴蝶兰(Phalaenopsis)[23]等物种的AP2保守结构域一致。在亲疏水性上,PoERF4蛋白为亲水性蛋白,与‘砀山酥梨’(Pyrus‘Dangshansuli’)[24]、杨树(Populus)[25]、芹菜(Apiumgraveolens)[26]等物种预测到的ERF4蛋白特性一致。在结构上,PoERF4蛋白均分布在膜外,不存在跨膜结构,表明该蛋白不属于跨膜蛋白,与番茄(Solanumlycopersicum)[27]、小麦(Triticumaestivum)[28]等物种预测到的蛋白结构一致。这些生物信息学预测结果将为牡丹PoERF4基因功能的进一步探究奠定理论基础。
利用RT-qPCR技术对PoERF4基因在‘凤丹’不同花期、不同组织、不同牡丹品种和生长素诱导后的表达模式进行分析,结果显示该基因在半开期的花瓣中表达量最高,表明PoERF4基因可能在花发育中期发挥重要作用。PoERF4在不同组织中均有表达,其中叶片表达量最高,在花萼和茎中表达量较低,表现出显著的组织特异性,巴西橡胶(Heveabrasiliensis)HbERF4基因[29]、棉花(Gossypiumhirsutum)GhERF4基因[30]和辣椒(Capsicumannuum)AgERF4基因[31]均在叶片显出组织特异性,有较高的表达量,推测其在植物生长发育过程中可能发挥不同的作用。本研究还发现在晚花品种‘莲鹤’的PoERF1基因表达量显著高于早花‘凤丹’突变株系和‘凤丹’。前人的研究表明,拟南芥ERF亚家族成员AtERF1基因可以抑制其在短日条件下开花[32]。在玫瑰中沉默RhERF113基因加速了玫瑰花的衰老[33]。由此推测ERF亚家族中部分成员可能具有延缓植物衰老的作用。AP2/ERF转录因子家族作为连接植物信号的关键调节器,可以调节乙烯、细胞分裂素、赤霉素和脱落酸等植物激素的生物合成与转录过程,同时也对生长素和茉莉酸等植物激素作出响应[34]。PoERF4基因可受到外源生长素处理的诱导,表明该蛋白在参与花瓣脱落等生长发育过程中可能受到生长素信号通路的调节[13]。这些研究结果可为进一步探究‘凤丹’牡丹PoERF4基因的功能提供参考,为植物花期调控基因工程的研究提供新的候选基因。
猜你喜欢凤丹生长素牡丹凤丹形态及其生理特性的季节动态研究特产研究(2022年6期)2023-01-17基于科学思维培养的“生长素的调节作用”复习课教学设计生物学通报(2021年4期)2021-03-16“三不够”牡丹节学生天地(2020年2期)2020-08-25探究生长素对植物生长的两重性作用科学大众(2020年12期)2020-08-13不同间作模式对田间小气候特征及凤丹光合特性和种实性状的影响植物资源与环境学报(2020年4期)2020-08-10生长素的生理作用研究乡村科技(2019年9期)2019-06-26浅谈生长素对植物的作用数码世界(2018年7期)2018-12-24凤丹籽油对小鼠H22肿瘤的抑制作用天然产物研究与开发(2018年3期)2018-05-07凤丹愈伤组织中丹皮酚含量的测定天然产物研究与开发(2018年3期)2018-05-07牡丹的整形修剪现代园艺(2017年13期)2018-01-19