阴红彬,谢立红,黄庆阳,徐明怡,2,罗春雨,沙刚,曹宏杰,2
(1.黑龙江省科学院 自然与生态研究所,黑龙江 哈尔滨 150040;
2.湿地与生态保育国家地方联合工程实验室,黑龙江 哈尔滨 150040)
土壤微生物是表征土壤健康质量和发育程度的重要指标,驱动土壤生态系统中物质、能量循环和流动,在维系生态系统健康、稳定和功能以及调节地球生物化学循环过程等方面具有关键作用[1],而且对森林生态系统地球化学元素循环有着重要影响[2]。植被类型改变凋落物性质和数量,从而显著影响土壤微生物群落代谢功能[3]。Reihold-hurek等[4]发现,土壤微生物群落代谢功能会受到土壤碳源输入种类的影响。刘秉儒等[5]研究表明,植被类型、植物物种多样性和地质环境条件等诸多外界环境因素不仅对土壤微生物的群落结构、功能以及生物活性等具有显著影响,同时还会改变土壤微生物群落多样性与生态功能的耦合关系[6-8],并且通过调节地上和地下群落的相互作用从而影响整个生态系统过程[9]。由于土壤微生物群落对环境驱动因子改变的响应敏感性存在差异,促使其可能对环境因素变化有不同的反应[9-10]。
土壤性质受地带性和非地带性成土条件控制,空间异质性强烈。火山土壤来源于火山熔岩和火山灰,与地带性土壤具有明显的差异,导致土壤微生物活性可能具有一定的特异性[11-12]。Xu等[13]和黄庆阳等[14]对五大连池火山群土壤微生物的研究结果表明,火山熔岩区基质性质和土壤发育时间对土壤细菌和真菌群落的物种组成和结构具有显著影响[15]。
五大连池火山群由7次喷发旋回形成的2座新期火山和12座老期火山构成[16],是我国保存最为完好的内陆单成因火山群。其不同喷发地质年代,导致各火山锥体的土壤发育时间及发育程度不同,土壤性质存在差异,可能影响土壤微生物群落结构和功能。Nemergut等[17]的研究表明,土壤微生物代谢功能的演变格局在土壤发育进程中具有明显的规律性特征。近年来,五大连池微生物方面的研究逐渐增多,主要包括微生物多样性、古菌分布规律、新期火山熔岩台地不同植被类型对土壤微生物的影响等[18],人为干扰对放线菌群落结构影响以及利用PLFA和高通量测序方法探讨不同年代火山的细菌、真菌和放线菌的组成等[13,19]。然而,不同地质年代火山的微生物碳源代谢多样性特征如何还未见报道。目前,Biolog微平板技术已广泛应用于不同生态系统、不同施肥处理、不同时间梯度和海拔梯度等土壤微生物碳源代谢多样性研究[20-23]。本文采用Biolog微平板技术,分析了五大连池火山群土壤微生物碳源代谢多样性,旨在探讨非地带性土壤微生物群落代谢功能特征,为土壤微生物群落功能与环境因子的协同进化关系以及土壤微生物功能的演化和地理分布特征研究提供依据。
1.1 研究区概况
研究样地(五大连池火山群)设置在五大连池火山国家级自然保护区,该保护区以新期火山保护为主,位于黑龙江省西北部,小兴安岭西南山麓与松嫩平原北部的过渡区域。保护区总面积约1 060 km2,南北宽约27 km、东西长约40 km,其地理坐标为东经126°00′~126°26′,北纬48°34′~48°48′。
该区地处寒温带大陆性季风区,夏季炎热短促,年均降水量为467 mm。地区年平均气温为0~0.5 ℃,每年6、7月份为盛夏季节,期间最高气温为38 ℃;
冬季寒冷而漫长,最低温出现在每年的1月份,最低气温可达到-42 ℃。无霜期110 d左右。五大连池植被属于温带阔叶混交林,优势乔木植物包括蒙古栎(Quercusmongolica)、山杨(Populusdavidiana)、黑桦(Betuladahurica)、白桦(Betulaplatyphylla)、落叶松(Larixgmelinii)和香杨(Populuskoreana)等[15]。
1.2 研究对象
根据五大连池火山群14座火山不同喷发年代、生态环境和人为干扰状况,选择老黑山、东焦得布山、小孤山、尾山和北格拉球山作为研究对象。参考已有研究结果将老黑山划分为新期火山,东焦得布山、小孤山、尾山和北格拉球山划分为老期火山[24](全新世之前,喷发时间距今大于1.0~1.2万年),采用“空间代替时间”的研究方法,利用不同火山的喷发时间代表不同的土壤发育时间,其中老黑山代表土壤发育时间为300年,东焦得布、小孤山、尾山和北格拉球分别代表土壤发育时间为17~19万年、28~34万年、40~50万年和70~80万年。研究地点基本概况见表1。
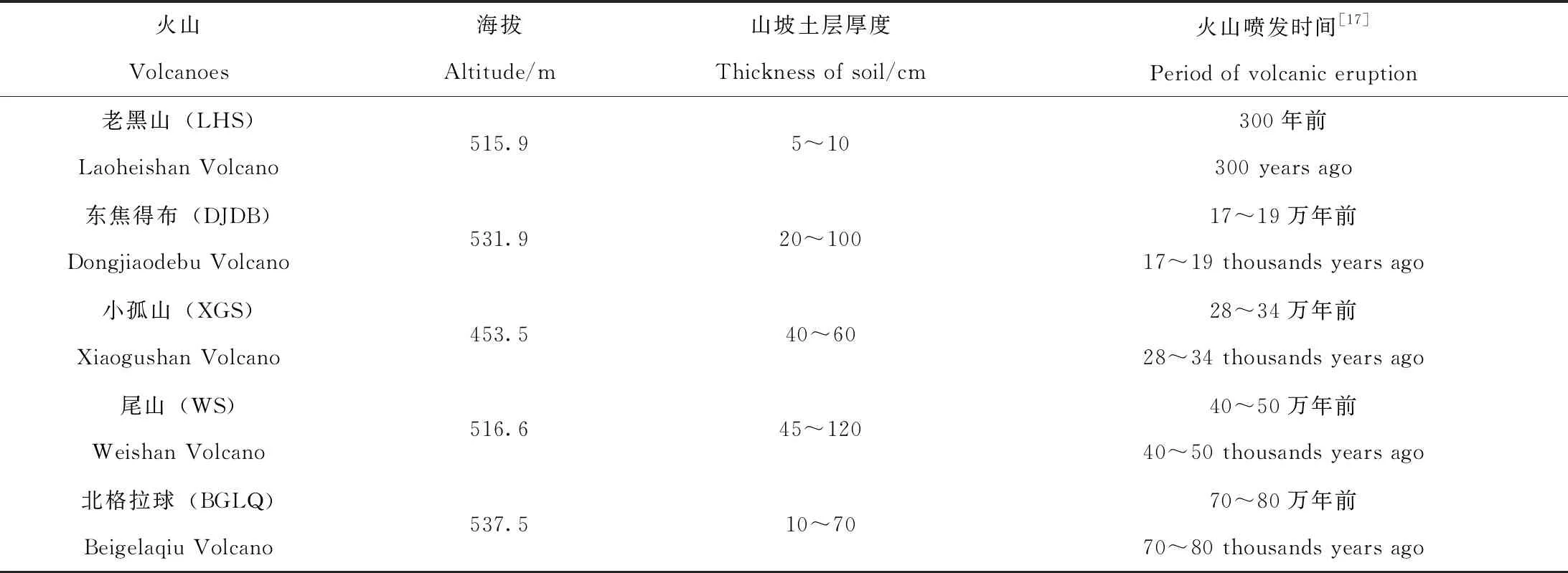
表1 五大连池不同喷发期火山的样地条件
1.3 采样方法
在每座火山南、北两个坡向距坡脚20 m的位置水平分别设置20 m×20 m的样方3个,每个样方间隔10 m,样方内中心和四周地点附近共设置5个采样点,采集0~10 cm的表层土壤样品。5个采样点的土壤样品混合均匀后去除明显的植物根系等有机残体,过2 mm孔径的尼龙筛。每个火山采集6个土壤样品,每个土壤样品大约500 g。其中100 g左右的土壤样品装入无菌袋中并放置在有冰袋的冰盒中,运回实验室后于4 ℃冰箱中保存,用于后续土壤微生物功能多样性测定;
剩余样品置于通风阴凉处自然风干处理,用于土壤理化指标测定。
1.4 分析方法
1.4.1 土壤理化性质测定。pH值用酸度计法(土水比为1∶2.5,赛多利斯/PB-10,德国);
含水量采用鼓风干燥箱105 ℃条件下,烘干至恒重后,通过水分损失量计算含水量(泰斯特/WGL-625B,中国);
总有机碳(TOC)和全氮(TN)采用元素分析仪测定(欧维特/EA3000,意大利);
硝态氮和铵态氮采用2 mol·L-1KCl浸提,流动分析仪测定(SKALAR/SAN++,荷兰);
全磷(TP)和速效磷(AP)分别采用氢氧化钠熔融-钼锑抗比色法和0.5 mol·L-1碳酸氢钠浸提-钼锑抗比色法测定(赛默飞世尔/Evolution 300,美国);
全钾(TK)和速效钾(AK)分别采用氢氧化钠熔融-火焰光度计法和1 mol·L-1的NH4OAC溶液浸提-火焰光度计法测定(悦丰/FP6410,中国);
溶解性有机碳(DOC)和溶解性有机氮(DON)采用总有机碳氮分析仪测定(耶拿/multi C/N 2100S,德国)[25]。
1.4.2 土壤微生物群落碳源代谢多样性的测定。利用通过高压灭菌的150 ml三角瓶称取4 ℃保存的新鲜土壤样品10.0 g,利用灭菌的分样器向三角品加入0.85%无菌氯化钠溶液100 ml,用封口膜封口。室温条件下,利用恒温振荡器震荡30 min,转速180转·min-1,温度25 ℃。充分摇匀后静置2 min,利用移液器吸取4 ml上清液后用0.85%氯化钠溶液定容至40 ml,吸取定溶液,在590 nm波长下测定吸光值,通过调整0.85%氯化钠溶液数量,将样品的吸光值调整到0.13。在利用八通道自动移液器吸取150 μl溶液于ECO板,盖上盖子至于25 ℃恒温培养箱中避光培养,每12 h测定1次590 nm处的吸光值,连续测定9 d,共计测定18次。
1.5 数据分析
利用平均颜色变化率(Average Well Color Development,AWCD)来描述土壤微生物碳源的代谢活性,其计算公式参照Garland等[26-27]的方法;
碳源代谢过程的动力学曲线通过非线性拟合获得[28],计算公式如下:
(1)
式中:K为拟合曲线的渐近线;
s为曲线达到渐近线定点一半时所需要的时间;
p为平均颜色变化的指数速率[28]。当平均光密度值达到0.8时,土壤微生物的碳源代谢处于指数增长时期,此时生长相对缓慢以及群落中不具代表性的微生物物种对碳源利用的贡献较大[28]。
采用培养96小时的实测数据计算碳源代谢多样性,具体的计算公式如下:
Shannon-Wiener多样性指数(H′):
(2)
McIntosh多样性指数(U):
(3)
Simpson优势度指数(Ds):
(4)
式中:Pi为第i个测定孔的相对吸光值与所有测定孔的相对吸光值总和的比值,其计算公式如下:
(5)
丰富度指数(S),本文S是指被微生物利用碳源种类的总数,当测定孔的吸光值≥0.2,就认为微生物对该类碳源具有代谢能力,计入微生物群落的丰富度[18,28]。
应用SPSS 25.0软件进行单因素方差分析(one-way ANOVA),采用最小显著差异法(Least Significant Difference,LSD)比较5座不同火山之间以及相同火山南、北两个坡向间的差异,差异显著性水平设为α=0.05;
应用R 4.0软件进行主成分分析(Principal Components Analysis,PCA),利用软件自带的princomp函数进行主成分计算,再利用ggplot作图;
应用R 4.0软件的vegan包进行去趋势对应分析(Detrended Correspondence Analysis,DCA),根据梯度值确定进行冗余分析(Redundancy Analysis,RDA),最后用ggplot作图;
应用Excel 2019软件进行31个单一碳源的吸光度值图绘制;
应用Origin 2019b进行碳源代谢过程的动力学曲线拟合和参数计算。
2.1 土壤微生物平均颜色变化率
AWCD是评估土壤微生物碳源代谢能力的一个重要参数[26]。由图1可知,随培养时间的延长AWCD逐渐增加,培养开始的24 h内AWCD无显著变化,各样品均低于0.045,此时碳源利用率较低;
AWCD在培养24~120 h时间段内快速升高,碳源利用率显著提升。各样品的AWCD变化趋势相似,北格拉球样点的AWCD值在培养过程中均高于其它4个样点。其它4个样点的AWCD值在培养过程中不同坡向上存在一定的差异,南坡东焦得布山的AWCD值在稳定之前低于其它火山,而北坡东焦得布山的AWCD值仅次于北格拉球,小孤山的AWCD值最低。
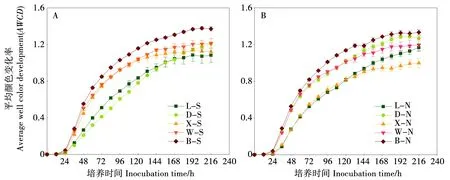
注:L-S、D-S、X-S、W-S和B-S分别代表老黑山、东焦得布山、小孤山、尾山和北格拉球山南坡,L-N、D-N、X-N、W-N和B-N分别代表老黑山、东焦得布山、小孤山、尾山和北格拉球山北坡。下同。
碳源代谢的曲线拟合结果表明,各样点的相关系数R2均大于0.99(表2)。不同年代火山AWCD变化的指数速率(P值)总体呈逐渐增加的变化趋势,北格拉球山土壤微生物对碳源利用率最快,东焦得布、小孤山和北格拉球南北坡差异显著(P<0.05)。K为渐近线代表最大吸光度,反映微生物对碳源利用潜力,不同年代火山K值除尾山外在南北坡均存在显著差异(P<0.05),尾山的K值在不同坡向均处于较高水平,表明其利用碳源能力最强,而小孤山北坡的土壤微生物碳源利用能力最弱。
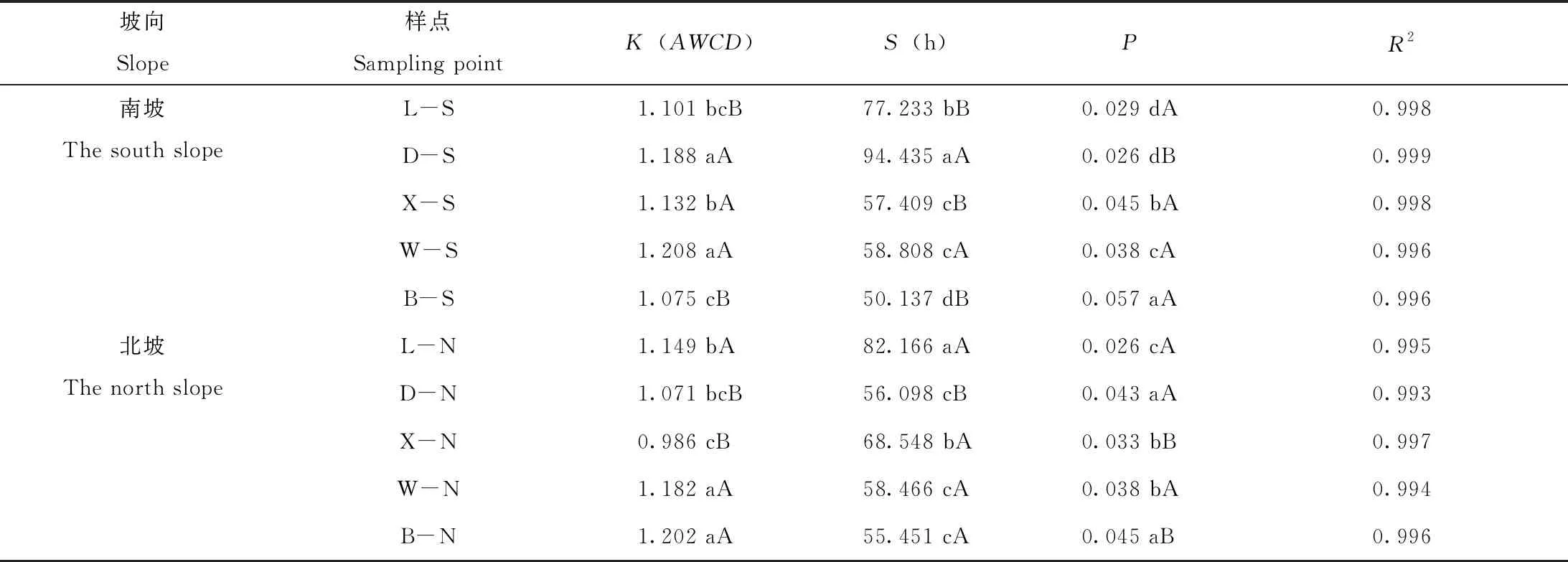
表2 拟合生长曲线的动力学参数
2.2 土壤微生物底物利用类型的差异
AWCD为0.8时可以表征更多的土壤微生物群落潜在功能[24]。主成分分析(PCA)表明,不同样点土壤微生物群落的碳源代谢格局存在明显差异(图2)。由图2-A可知,第一主成分(PC1)解释变异量的80.85%,第二主成分(PC2)解释变异量的12.54%。与PC1显著负相关的碳源是酯类(ES)、糖类(CH)和带磷基糖类(CH.P),与PC2显著正相关的碳源是胺类(AM)。南坡土壤微生物的碳源利用差异主要是由糖类(CH)和酯类(ES)引起的,二者合计解释总变异量的64.93%。氨基酸类(AA)是东焦得布山样点碳源代谢的主要类型。由图2-B可知,PCA分析提取的第一主成分(PC1)解释变异量的70.13%,第二主成分(PC2)解释变异量的19.77%。与PC1显著正相关的碳源是聚合物(PM),与PC2显著正相关的碳源是带磷基糖类(CH.P),与PC2显著负相关的碳源是胺类(AM)。北坡土壤微生物的碳源利用差异主要是由带磷基糖类(CH.P)和酯类(ES)引起的,二者合计解释总变异量的80.41%。东焦得布山和北格拉球利用的碳源类型主要是糖类(CH)和带磷基糖类(CH.P),小孤山利用的碳源类型主要是羧酸类(CA)和聚合物(PM),尾山利用的碳源类型主要是酯类(ES),而老黑山没有明显的碳源利用类型。
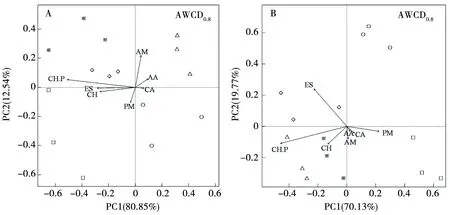
注:CH代表糖类;
CH.P代表带磷基的糖类;
CA代表羧酸类;
AA代表氨基酸类;
AM代表胺类;
ES代表酯类;
PM代表聚合物。图中○、△、□、◇和※为样点,分别代表老黑山、东焦得布、小孤山、尾山和北格拉球山。下同。
2.3 土壤微生物底物利用种类的差异
通过比较培养216 h后每个样品在各孔的OD值,反映微生物群落对31种碳源的代谢差异。由图3可知,土壤微生物对Gly利用能力较弱。老黑山南坡土壤微生物对MetGlu、Gluc、Lac(α-D-乳糖)、Ma、Thr、Glu和PyAMEs利用能力低于其它四座火山;
北坡小孤山土壤微生物对MetGl、Xyl、GalLa、HydBut、PheAla、Thr、GluPho和PyAMEs等17种底物的利用能力均新期火山和其它3座老期火山;
南、北2个坡向间微生物对主要碳源种类的代谢能力差别很小。

注:MetGlu代表β-甲基-D-葡萄糖苷;
Xyl代表D-木糖/戊醛糖;
Ery代表i-赤藓糖醇;
Man代表D-甘露醇;
AceGluc代表N-乙酰-D-葡萄糖氨;
Gluc代表D-葡糖胺酸;
Cell代表D-纤维二糖;
Lac代表α-D-乳糖:Gal代表D-半乳糖酸;
GalLa代表D-半乳糖醛酸γ-内酯;
2.HydBen代表2-羟基苯甲酸;
4.HydBen代表4-羟基苯甲酸;
KetBut代表α-丁酮酸;
Ita代表衣康酸;
HydBut代表γ-羟基丁酸;
Ma代表D-苹果酸;
PheAla代表L-苯基丙氨酸;
Arg代表L-精氨酸;
Thr代表L-苏氨酸;
Asp代表L-天门冬酰胺;
Glu代表甘氨酰-L-谷氨酸;
Ser代表L-丝氨酸;
GluPho代表1-磷酸葡萄糖;
Gly代表D,L-α-磷酸甘油;
PheAm代表苯乙基胺;
Tw40代表吐温40;
Tw80代表吐温80;
Cyc代表α-环式糊精;
Gl代表肝糖;
PyAMEs代表丙酮酸甲酯。Note:MetGlu indicates β-methyl-D-glucoside; Xyl indicates D-xylose;Ery indicates i-erythritol;Man indicates D-mannitol;AceGluc indicates N-acetyl-D-glucosamine;Gluc indicates D-glucosaminic acid;Cell indicates D-cellobiose;Lac indicates α-D-lactose;Gal indicates D-galacturonic acid;GalLa indicates D-galactonic acid γ-lactone;2.HydBen indicates 2-hydroxy benzoic acid;4.HydBen indicates 4-hydroxy benzoic acid;KetBut indicates a-ketobutyric acid;Ita indicates itaconic acid;HydBut indicates γ-hydroxy butyric acid;Ma indicates D-malic acid;PheAla indicates L-phenylalanine;Arg indicates L-arginine;Thr indicates L-threonine, Asp indicates L-asparagine;Glu indicates glycyl-L-glutamic acid;Ser indicates L-serine;GluPho indicates glucose 1-phosphate,Gly indicates D,L-a-glycerol;PheAm indicates phenylethyl-amine;Pu indicates putrescine;Tw40 indicates Tween40;Tw80 indicates Tween80;Cyc indicates a-cyclodextrin;Gl indicates glycogen;PyAMEs indicates yruvic acid methyl ester.
2.4 土壤微生物底物代谢多样性
不同地质年代火山相同坡向土壤微生物碳源代谢的α多样性指数均无明显的变化趋势(表3)。方差分析结果表明,除南坡McIntosh多样性指数外其它多样性指数均无显著差异;
新期火山(老黑山)南坡和北坡之间Shannon-Wiener指数(H′)、Simpson优势度指数(Ds)和丰富度指数(S)具有显著差异(P<0.05),其它四座老期火山在南、北坡向之间差异不显著。
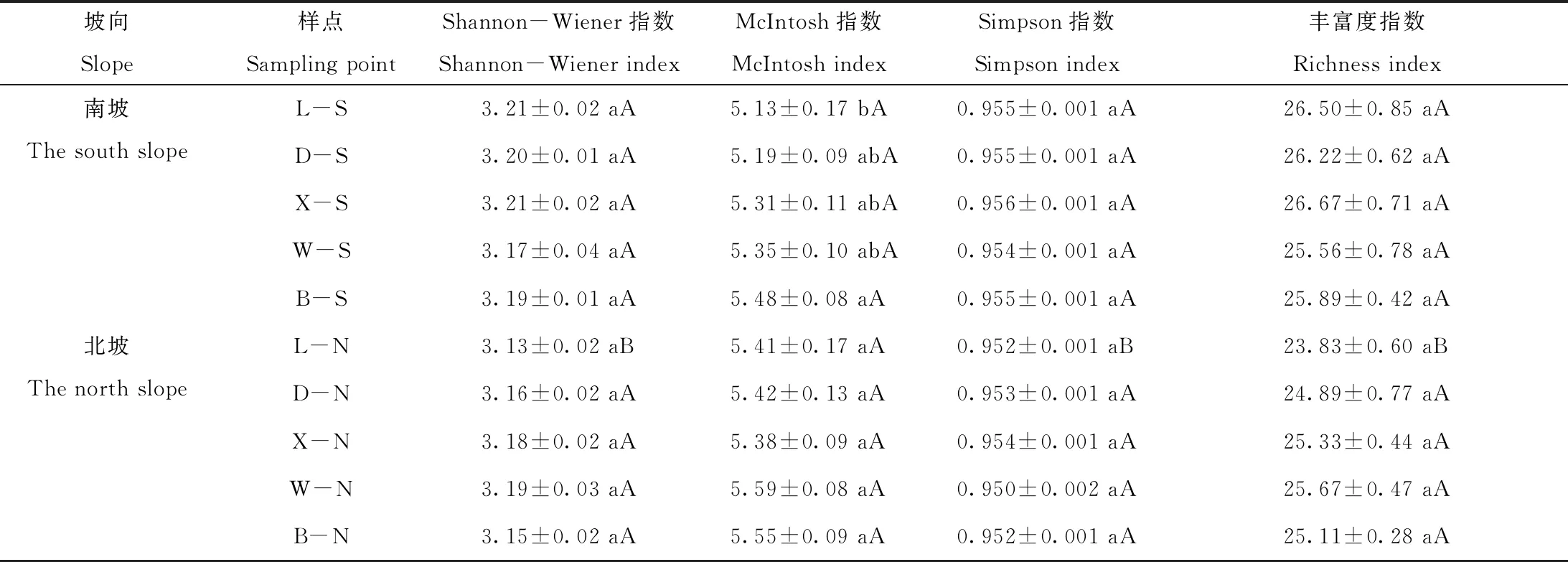
表3 土壤微生物碳源代谢多样性
2.5 土壤理化因子对微生物碳源代谢类型的影响
冗余分析结果表明(图4)土壤理化性质对不同地质年代火山土壤微生物碳源利用类型具有显著的影响,南坡糖类和带磷基的糖类代谢能力主要受C∶N和总钾含量的影响,羧酸类、氨基酸类、酯类、聚合物类和胺类更易受到速效钾、硝态氮和可溶性有机碳的影响(图4A);
北坡酯类和羧酸类代谢主要受土壤总磷的影响,带磷基的糖类代谢主要受速效磷和铵态氮的影响,速效钾、可溶性有机氮、pH和硝态氮影响微生物对糖类和胺类的代谢能力,聚合物的代谢主要受C∶N的影响,而氨基酸类底物代谢更易受到溶解性有机氮的影响(图4B)。

注:TP代表全磷;
TC代表全碳;
TN代表全氮;
TK代表全钾;
AP代表有效磷;
AK代表速效钾;
DON代表可溶性有机氮;
DOC代表可溶性有机碳;
代表铵态氮;
代表硝态氮;
CH代表糖类;
CH.P代表带磷基的糖类;
CA代表羧酸类;
AA代表氨基酸类;
AM代表胺类;
ES代表酯类;
PM代表聚合物。下同。
2.6 土壤理化因子对微生物群落碳源代谢α多样性的影响
冗余分析结果表明(图5),南坡土壤总有机碳、总氮、溶解性有机氮和N∶P与Shannon-Wiener指数(H′)、Simpson指数(Ds)和丰富度指数(S)间均具有显著的正相关关系,McIntosh指数(U)与C∶N之间也具有显著的正相关关系(图5A);
北坡土壤铵态氮、溶解性有机氮、pH、总有机碳、总氮、速效磷和N∶P与Shannon-Wiener指数(H′)之间具有正相关关系,总碳、总氮、溶解性有机氮、铵态氮和N∶P与丰富度指数(S)具有显著的正相关关系,Simpson指数(Ds)更易受到总磷和总钾的影响,McIntosh指数(U)与C∶N之间具有正相关关系(图5B)。

图5 多样性指数和环境因子的冗余分析
土壤微生物在森林生态系统中起着重要作用,对森林生态系统地球化学元素循环有着重要影响[29]。火山喷发后,植被逐渐恢复,随着时间的延长,植被类型改变直接影响凋落物。作为土壤有机物质的重要来源,凋落物性质和数量的变化会显著影响土壤微生物群落代谢功能[2-3]。本研究中,微生物群落对碳源利用能力在不同地质年代火山之间存在一定的差异(图2),但AWCD值在时间梯度上没有明显的规律性。吴则焰等[30]认为植被类型是影响土壤微生物群落结构和功能的重要因素。本研究选择的5座不同地质年代的火山,除老黑山外其余4座火山的形成时间距今年代较为久远(表1),植被恢复已进入稳定阶段,占优势的晚期演替树种对土壤理化性质及营养状况的影响逐渐加深,显著影响土壤微生物的群落结构和功能。植物凋落物种类、数量、光合产物向地下分配的数量以及根系分泌物等对土壤微生物群落中特定种群发育具有特异性刺激,进而通过改变土壤微生物物种组成和数量来影响群落特征[31]。植物和微生物具有显著的协同进化关系[32],因此,处于相似环境条件的不同地质年代火山植物组成和群落结构、多样性的差异可能是导致土壤微生物表现出不同的碳源利用特征的重要原因。
碳源利用能力指标强弱反映利用特定碳源的土壤微生物种群数量的多寡[33]。因此,不同地质年代火山土壤微生物群落物种组成存在差异[14-15]可能是引起微生物的碳源代谢格局差异的重要原因。本研究中,除老黑山外,其它4座火山在植被类型上没有显著地差异,这可能是不同火山的碳源利用类型没有显著差异的主要原因。研究表明,生态系统在植被演替过程中,植物群落物种组成和类型的差异以及演替阶段等均会对土壤微生物群落组成和代谢能力产生影响[34]。不同演替阶段和植物群落物种组成影响生态系统调落物等有机碳源的输入数量和质量,影响微生物食源结构和数量,通过促进或抑制特定微生物种类的繁殖进而改变土壤微生物群落数量、组成和结构[2],进而影响土壤微生物代谢能力。五大连池火山虽然在植被类型上具有相似性但群落组成和土壤性质在不同火山之间却存在一定的差异,这也可能是导致不同火山在碳源利用能力上产生差异的原因。
土壤环境异质性较强,为微生物提供多样性的栖息地同时也塑造了其代谢功能的多样性。Tate等[35]研究发现,森林生态系统植被演替过程中土壤理化性质显著影响土壤微生物群落的碳源代谢类型和多样性。本研究结果也表明,土壤C∶N、溶解性有机氮和pH等理化因子对微生物碳源代谢类型和多样性具有显著影响,但对不同地质年代火山的影响程度不同。五大连池不同地质年代火山由于形成时间的差异,土壤理化性质必然存在一定的差异,尤其是不同坡向上土壤理化性质之间差异显著。研究表明,坡向显著影响土壤微生物群落结构[13]。坡向对土壤微生物的影响主要依赖于温度和湿度[36]。在本研究区域,不同火山所处位置的降水量的变化范围较小,土壤微生物群落代谢功能差异可能主要受土壤温度的调节[37]。由于北坡土壤温度较低,土壤微生物活性和有机质降解速率低于南坡土壤,造成土壤有机质和一些养分因子高于南坡[36-37]。微生物群落结构、功能特征反映其生境特征,理化性质和微生物群落功能密切相关且相互作用[38]。因此,土壤微生物群落结构及其环境差异可能是重要原因[14]。
(1)不同地质年代火山土壤样品微生物碳源代谢的AWCD变化趋势相似,北格拉球山AWCD值最高,对碳源利用率最快,尾山碳源利用能力最强,小孤山北坡的土壤微生物碳源利用能力最弱。
(2)土壤微生物碳源利用潜力在南北2个坡向上存在显著差异。C∶N、溶解性有机氮和pH等土壤理化因子对土壤微生物碳源利用类型和代谢多样性具有显著的影响,北坡土壤微生物的碳源代谢功能受到更多的环境因素影响。
猜你喜欢碳源火山群落缓释碳源促进生物反硝化脱氮技术研究进展环境工程技术学报(2022年3期)2022-06-05大学生牙龈炎龈上菌斑的微生物群落昆明医科大学学报(2022年2期)2022-03-29竹豆间种对柑橘园土壤化学性质及微生物碳源代谢特征的影响中国土壤与肥料(2021年5期)2021-12-02合成微生物群落在发酵食品中的应用研究食品安全导刊(2021年20期)2021-08-30不同碳源对铜溜槽用铝碳质涂抹料性能的影响昆钢科技(2021年6期)2021-03-09海底火山群小猕猴智力画刊(2020年12期)2021-01-07我国西北某陆地油田采出水微生物群落结构河南科学(2020年3期)2020-06-02有趣的火山图数学大王·中高年级(2019年10期)2019-11-04火山小天使·四年级语数英综合(2019年11期)2019-01-13我是火山小学生导刊(低年级)(2017年2期)2017-06-10